本記事では、『熱サイクル~熱機関と熱効率~』について解説していきたいと思います。

予備校講師ともくん
専門科目:物理
経歴:東北大学物理学科
→東北大学大学院理学研究科物理学専攻
→公務員(教職ではない)
→塾業界に転職
→予備校&塾に出講中のプロ講師
長い講師歴で数千人近くの生徒を送り出してきました。実際にいろいろな生徒と接する中で培った経験値を活かして、より多くの読者の皆様が将来の夢をかなえることができるようお手伝いできればと思っています。
熱機関
蒸気機関のように,熱の吸収,放出をくり返して熱を仕事に変換する装置を熱機関という。
気体の状態が,ある状態AからA→B→C→D→Aのようにさまざまな状態変化を経てもとの状態Aにもどるとき,これをサイクルという。
<熱サイクルの例>
下図のような熱サイクルを考えよう。ここでは単原子分子理想気体\(n\)[mol]に対して,図の4つの過程を繰り返して状態を変化させた。
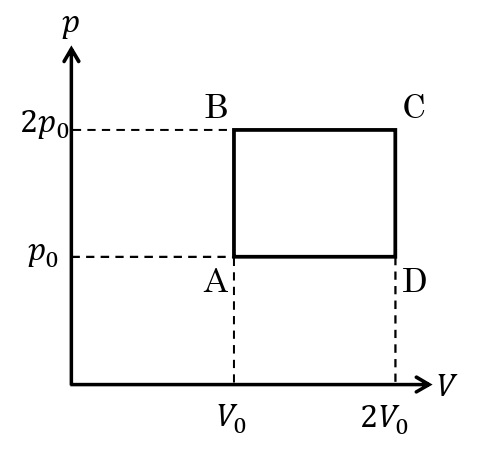
まず,ボイルシャルルの法則より,
\begin{eqnarray}\frac{p_0V_0}{T_A}=\frac{2p_0V_0}{T_B}=\frac{2p_0\cdot 2V_0}{T_C}=\frac{p_0\cdot 2V_0}{T_D}\end{eqnarray}
よって,\(T_B=2T_A\),\(T_C=4T_A\),\(T_D=2T_A\)が成り立つ。
A→Bの過程(定積加圧)
定積変化より,
\begin{eqnarray}W_{AB}=0\end{eqnarray}
また,
\begin{eqnarray}\displaystyle\it\Delta U_{AB}\rm=\frac{3}{2}\it nR\rm(\it T_B\rm-\it T_A\rm)=\frac{3}{2}\it nRT_A\end{eqnarray}
よって,熱力学第一法則より,
\begin{eqnarray}Q_{AB}=\it\Delta U_{AB}\rm+\it W_{AB}\rm=\dfrac{3}{2}\it nRT_A\end{eqnarray}
B→Cの過程(定圧膨張)
定圧変化より,
\begin{eqnarray}W_{BC}&=&2p_0(2V_0-V_0)\\&=&2p_0V_0\\&=&2nRT_A\end{eqnarray}
また,
\begin{eqnarray}\displaystyle\it\Delta U_{BC}&=&\frac{3}{2}\it nR\rm(\it T_C-T_B\rm)\\&=&\frac{3}{2}\it nR\cdot\rm2\it T_A\\&=&3\it nRT_A\end{eqnarray}
よって,熱力学第一法則より,
\begin{eqnarray}Q_{BC}=\it\Delta U_{BC}\rm+\it W_{BC}=\rm5\it nRT_A\end{eqnarray}
C→Dの過程(定積減圧)
定積変化より,\begin{eqnarray}W_{CD}=0\end{eqnarray}
また,
\begin{eqnarray}\displaystyle\it\Delta U_{CD}\rm&=&\frac{3}{2}\it nR\rm(\it T_D-T_C\rm)\\&=&-3\it nRT_A\end{eqnarray}
よって,熱力学第一法則より,\begin{eqnarray}Q_{CD}=\it\Delta U_{CD}\rm+\it W_{CD}\rm=-3\it nRT_A\end{eqnarray}
D→Aの過程(定圧圧縮)
定圧変化より,\begin{eqnarray}W_{DA}&=&p_0(V_0-2V_0)\\&=&-p_0V_0\\&=&-nRT_A\end{eqnarray}
また,
\begin{eqnarray}\displaystyle\it\Delta U_{DA}\rm&=&\frac{3}{2}\it nR\rm(\it T_A-T_D\rm)\\&=&-\frac{3}{2}\it nRT_A\end{eqnarray}
よって,熱力学第一法則より,\begin{eqnarray}Q_{DA}=\it\Delta U_{DA}\rm+\it W_{DA}\rm=-\dfrac{5}{2}\it nRT_A\end{eqnarray}
結果
ここで,1サイクルで気体が吸収する熱量\(Q_{in}\)[J]と,放出する熱量\(Q_{out}\)[J]とすると,
\begin{eqnarray}Q_{in}&=&Q_{AB}+Q_{BC}\\&=&\frac{3}{2}nRT_A+5nRT_A\\&=&\frac{13}{2}nRT_A\end{eqnarray}
\begin{eqnarray}Q_{out}&=&Q_{CD}+Q_{DA}\\&=&3nRT_A+\frac{5}{2}nRT_A\\&=&\frac{11}{2}nRT_A\end{eqnarray}
となる。また,1サイクルのうち,B→Cの過程で気体は外部に対し\(W_{BC}=2nRT_A\)の仕事をし,D→Aの過程で気体は外部から\(|W_{DA}|=nRT_A\)の仕事をされる。したがって,この1サイクルで気体がする仕事は,
\begin{eqnarray}W&=&2nRT_A-nRT_A\\&=&nRT_A\\&=&p_0V_0\\&=&(2p_0-p_0)(2V_0-V_0)\end{eqnarray}
と変形できる。これは,1サイクルが\(p\)-\(V\)グラフで囲む領域の面積に等しい。
熱効率
1サイクルの中で高温の物体から吸収した熱量を\(Q_{in}\)[J],低温の物体に放出した熱量を\(Q_{out}\)[J]とする。1サイクルするともとの状態にもどるので内部エネルギーの変化\(\it\Delta U\)は\(0\)となる。よって,熱力学第一法則より,
\begin{eqnarray}W=Q_{in}-Q_{out}\end{eqnarray}
が成り立つ。1サイクルで,吸収した熱量\(Q_{in}\)のうち,仕事\(W\)に変換された割合を熱効率という。以上より,熱効率は
\begin{eqnarray}e=\frac{W}{Q_{in}}=1-\frac{Q_{out}}{Q_{in}}\end{eqnarray}
とあらわすことができる。
<例>で扱った熱サイクルの熱効率を求めてみよう。ここで,1サイクルで吸収した熱量は\(Q_{in}=\dfrac{13}{2}nRT_A\),\(W=nRT_A\)であることから
\begin{eqnarray}e=\frac{W}{Q_{in}}=\frac{nRT_A}{\frac{13}{2}nRT_A}=\frac{2}{13}\end{eqnarray}
となる。










コメント